Research
LAZARUS/ラザルス
OISHI/大石
Molecular links between sleep and motivation
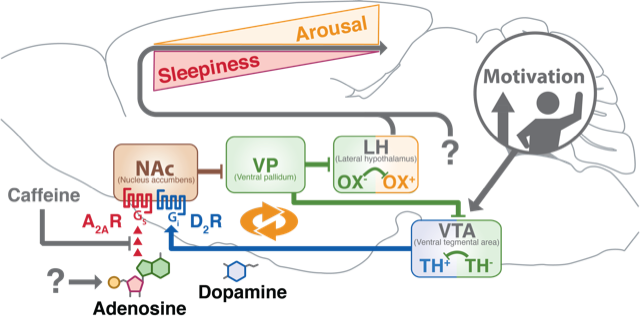
The sleeping habits of humans are unique in the sense that we often defy sleep and stay awake for occupational and recreational reasons or other lifestyle choices, despite experiencing fatigue during that time. The motivation to defy sleep and stay awake for a wide range of lifestyle choices is often accompanied by the use of psychoactive substances, most prominently caffeine. Our groundbreaking work includes discovering that caffeine triggers wakefulness by blocking adenosine A2A receptors in the nucleus accumbens, a part of the brain associated with motivation, and identifying the brain circuit that links sleepiness and motivation. We are using innovative genetically or chemically engineered systems (optogenetics, chemogenetics, or optopharmacology) in conjunction with in-vivo imaging.
Related publications:
Oishi Y, et al., Nat Commun, 8:734, 2017
Lazarus M, et al., J Neurosci, 31:10067–10075, 2011
睡眠とモチベーションをつなぐ分子・細胞メカニズム
コーヒーやお茶などに含まれるカフェインは世界で最もよく摂取される向精神物質のひとつであり、その覚醒効果がよく知られています。そのメカニズムは長らく謎でしたが、我々は最近、薬物依存や動機付け行動に重要とされる脳部位・側坐核を介して、カフェインが覚醒効果を示すことを見出しました。また、化学遺伝学および光遺伝学技術により側坐核の神経活動を操作した結果、強力な徐波睡眠(ノンレム睡眠;睡眠の主成分)誘発作用が見出されました。モチベーション刺激が無い時に眠くなるのは、側坐核の作用かもしれません。
関連論文:
Oishi Y, et al., Nat Commun, 8:734, 2017
Lazarus M, et al., J Neurosci, 31:10067–10075, 2011
Drugs for insomnia and psychotic conditions
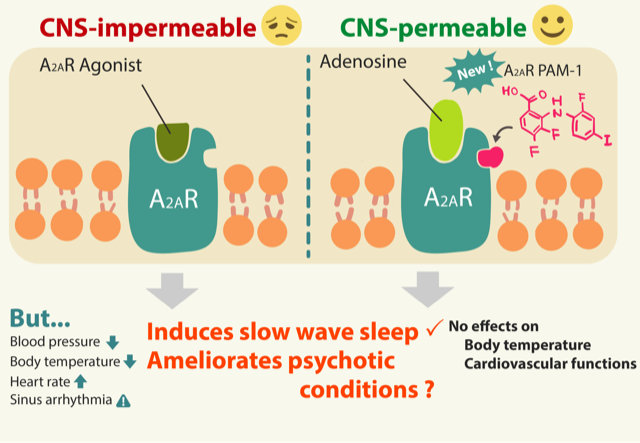
We developed the first positive allosteric modulator of adenosine A2A receptors, named A2AR PAM-1, that evokes A2AR responses in the brain (e.g., sleep induction) without affecting cardiovascular function, unlike classic A2AR agonists. Given that A2AR are also implicated in psychotic conditions, enhanced A2AR signaling may constitute an important molecular mechanism for sleep regulation and sound mental health. Furthermore, we collaborate with the Abe Lab (Hiroshima University) to develop a visible-light (420 nm) photoactivatable (‘caged’) A2AR PAM-1. Using the opto-version of the A2AR PAM, we, for the first time, optochemically induced sleep in freely behaving mice. Our approach should aid in generating visible-light photoactivatable compounds for virtually any druggable target.
Related publication:
Korkutata M, et al., Neuropharmacology, 153:153, 2019
不眠症や精神病の治療薬の開発
我々は最近、アデノシンA2A受容体のポジティブアロステリックモジュレーター(A2AR PAM-1)を開発しました。この物質は、従来のA2ARアゴニストとは異なり、心血管機能に影響を与えることなく脳内でA2AR反応(睡眠誘導など)を誘発します。A2ARは精神疾患にも関与していることから、A2ARシグナルの増強は睡眠調節や健全な精神状態の維持に重要な可能性があります。さらに、広島大学の阿部研究室と共同で、可視光(420nm)で光活性化できるA2AR PAM-1を開発しています。この光作動型A2AR PAM-1を用いて、初めて自由行動下マウスに光化学的に睡眠を誘導することに成功しました。この方法は、あらゆる薬物標的に対して可視光で光活性化できる化合物の創製に役立つと思われます。
関連論文:
Korkutata M, et al., Neuropharmacology, 153:153, 2019
Crosstalk between sleep and immune system
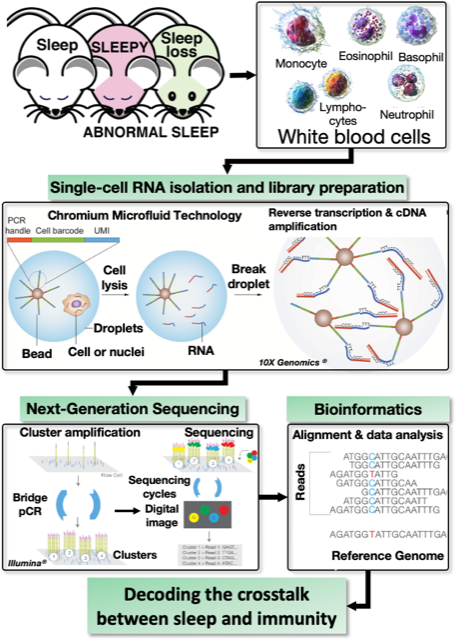
Good nutrition and sleep are the keys to a disease-free life. It has been shown that the differentiation and proliferation of immune cells, such as white blood cells, are synchronized with sleep. However, the molecular mechanisms by which sleep regulates immune system function are still largely unknown. We analyze gene expression in leukocytes obtained from peripheral blood of sleep-deprived and mutant mice with abnormally increased sleep need by single-cell gene expression analysis and identify candidate molecules that intervene in sleep quantity and immune system regulation. Single-cell gene and immune profiling represent the most advanced and comprehensive approach to reveal the immunological signature in thousands of individual cells simultaneously.
睡眠と免疫のクロストーク
良質な栄養と睡眠は、病気知らずの生活を送るための鍵です。実際、白血球などの免疫細胞の分化・増殖が睡眠と同期していることが明らかになっています。しかし、睡眠が免疫系機能を調節する分子メカニズムはまだほとんど分かっていません。我々は、睡眠不足マウスと睡眠必要量が異常に増加した変異マウスの末梢血から得られた白血球の遺伝子発現をシングルセル遺伝子発現解析により網羅的に解析し、睡眠量と免疫系の調節に介在する候補分子を同定します。シングルセル遺伝子および免疫プロファイリングは、数千の個々の細胞に見られる免疫学的シグネチャーを同時に明らかにする最も先進的かつ包括的なアプローチと考えています。
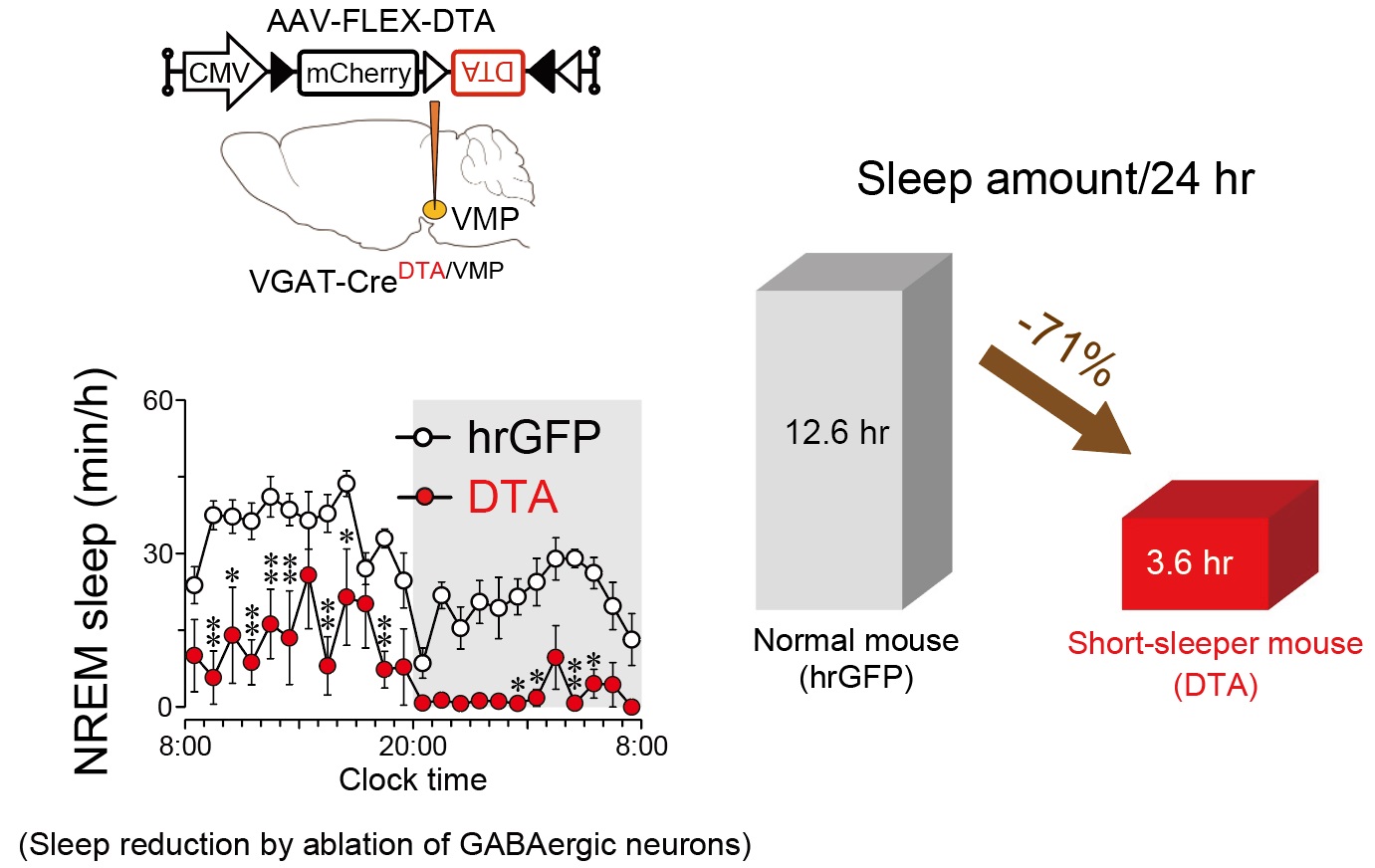
Short-sleeper mice to understand sleep
People spend approximately one-third of their life sleeping. Why sleep is compulsory for human life and cannot be avoided, however, remains unclear. It is important to understand why sleep is necessary and how sleep is controlled – not only to elucidate physiological behavior but also to enhance our quality of life.
Recently, in the course of analyzing sleep-wake regulation by the reward system, we accidentally created mice that require an extremely low amount of sleep. Using multiple “short sleep” models, including this novel mouse model, we study the effect of short sleep on other physiological functions in the body to understand the significance of sleep. We also study the neural mechanisms of short sleep to clarify the control mechanisms of sleep.
Related publications:
Honda T, et al., iScience, 23(6):101240, 2020
Takata Y, et al., J Neurosci, 38(47):10080-10092, 2018
短眠マウスで探る睡眠のメカニズムと意義
私たちは一生の約3分の1を眠って過ごします。しかしなぜ睡眠が必要なのかは明らかではありません。生理機能の理解だけでなく、良質な社会生活を目指すという意味でも、睡眠の意義や制御に関する研究は重要と言えます。
睡眠の研究が進まない理由の一つは、適切なモデル動物が少ないためです。我々は最近、睡眠量が極端に少ないマウスを偶然創り出しました。我々は、このマウスを含む複数の“短眠”モデルを用いて、短眠が生体に与える影響を明らかにし、睡眠の意義の理解を目指します。その一方で、短眠が作られる仕組みを研究し、睡眠制御メカニズム解明に挑みます。これまでに全く知られていなかったメカニズムが対象になるため、新規の睡眠改善薬などの開発につながる可能性があります。
関連論文:
Honda T, et al., iScience, 23(6):101240, 2020
Takata Y, et al., J Neurosci, 38(47):10080-10092, 2018

Neural mechanisms of brain slow-wave generation
We get sleepy every day, but the neural mechanism is currently unclear. We have recently developed a mouse model that can generate “slow waves,” a measure of sleepiness, using the mechanism of drugs that induce sleepiness. In this study, we aim to elucidate the mechanism of slow-wave generation using this model and to understand the principle of sleepiness generation.
眠気の神経メカニズムを解明する
私たちは毎日眠くなりますが、その神経メカニズムは現在明らかではありません。我々は最近、眠気を催す薬剤の仕組みを利用して、眠気の指標である「徐波」を生成できるマウスモデルを独自に開発しました。本研究ではこのモデルを利用して、徐波生成機序を明らかにし、眠気発生原理の理解を目指します。

